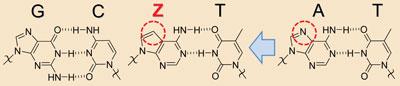
-
Tracked from 현금섯다 2019/07/16 18:46
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Zamvi.Dothome.Co.Kr 2019/07/17 05:55
Delete
Neoways의 막나가는 분자생물학
-
Tracked from 현금 바둑이 2019/07/20 06:57
Delete
Neoways의 막나가는 분자생물학
-
Tracked from offerov.Net 2019/07/20 08:20
Delete
Neoways의 막나가는 분자생물학
-
Tracked from 온라인카지노 2019/07/20 13:30
Delete
Neoways의 막나가는 분자생물학
-
Tracked from 온라인카지노 2019/07/20 14:44
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Raahhosting.Net 2019/07/21 06:57
Delete
Neoways의 막나가는 분자생물학
-
Tracked from 온라인카지노 2019/07/21 08:24
Delete
Neoways의 막나가는 분자생물학
-
Tracked from scuttle.woofcats.com 2019/07/21 10:38
Delete
Neoways의 막나가는 분자생물학
-
Tracked from www.bookmarksway.com 2019/07/21 17:50
Delete
Neoways의 막나가는 분자생물학
-
Tracked from mllab.sogang.Ac.kr 2019/07/22 23:55
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Fortnite Hack Free Downloa 2019/07/24 07:15
Delete
Neoways의 막나가는 분자생물학
-
Tracked from best shampoo for oily hair but dry scalp 2019/07/24 07:21
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Fortnite esp 2019/07/24 09:52
Delete
Neoways의 막나가는 분자생물학
-
Tracked from ensha 2019/07/24 16:06
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Fortnite CHEAT Free Downloa 2019/07/24 20:48
Delete
Neoways의 막나가는 분자생물학
-
Tracked from חינוך ילדים 2019/07/24 22:34
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from fortnite aimbot 2019/07/26 23:45
Delete
Neoways의 막나가는 분자생물학
-
Tracked from best shampoo for oily hair boots 2019/07/27 10:02
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Support Asx 4 official 2019/07/27 16:18
Delete
Neoways의 막나가는 분자생물학
-
Tracked from fortnite aimbot 2019/07/27 20:41
Delete
Neoways의 막나가는 분자생물학
-
Tracked from getmyfollowers 2019/07/28 14:50
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Fortnite Wallhack 2019/07/29 12:57
Delete
Neoways의 막나가는 분자생물학
-
Tracked from fortnite aimbot 2019/07/30 02:42
Delete
Neoways의 막나가는 분자생물학
-
Tracked from over here 2019/07/30 13:36
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from the best shampoo for hair loss uk 2019/07/30 23:47
Delete
Neoways의 막나가는 분자생물학
-
Tracked from anchortext 2019/07/31 07:34
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Fortnite esp 2019/07/31 20:12
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Fortnite CHEAT Free Downloa 2019/08/01 21:46
Delete
Neoways의 막나가는 분자생물학
-
Tracked from 온라인카지노 2019/08/01 22:09
Delete
Neoways의 막나가는 분자생물학
-
Tracked from 더킹카지노 2019/08/05 11:14
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Techimportant.Com 2019/08/05 17:01
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Fortnite Hacks 2019/08/05 19:11
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Www.Gagopar.Co.kr 2019/08/06 03:10
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Fortnite CHEAT Free Downloa 2019/08/06 04:04
Delete
Neoways의 막나가는 분자생물학
-
Tracked from web 2019/08/07 01:07
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Newsreddit.Esy.es 2019/08/07 01:41
Delete
Neoways의 막나가는 분자생물학
-
Tracked from 사이다 쿨 2019/08/07 04:35
Delete
Neoways의 막나가는 분자생물학
-
Tracked from web 2019/08/07 16:05
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from bandarq online 2019/08/08 12:54
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from essentialmedicalmarketing.com 2019/08/10 02:43
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from homepage 2019/08/10 08:22
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from web 2019/08/11 01:50
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from landscapers LA 2019/08/11 06:54
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Fortnite Hacks 2019/08/11 08:15
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Fortnite Cheat 2019/08/11 08:43
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Fortnite Cheat 2019/08/11 11:08
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Fortnite Cheat 2019/08/12 00:54
Delete
Neoways의 막나가는 분자생물학
-
Tracked from fortnite aimbot 2019/08/12 19:03
Delete
Neoways의 막나가는 분자생물학
-
Tracked from web 2019/08/13 00:07
Delete
Neoways의 막나가는 분자생물학
-
Tracked from mdpark-Xi.co.kr 2019/08/13 02:26
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Fortnite CHEAT Free Downloa 2019/08/13 19:36
Delete
Neoways의 막나가는 분자생물학
-
Tracked from fortnite hack 2019/08/14 03:21
Delete
Neoways의 막나가는 분자생물학
-
Tracked from technology 2019/08/15 20:17
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 岡山県の解鍵を解説 2019/08/16 01:31
Delete
Neoways의 막나가는 분자생물학
-
Tracked from bandar togel diskon terbesar 2019/08/19 13:02
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from web 2019/08/19 14:48
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from アンダーアーマーを解説 2019/08/19 16:02
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Instagram followers 2019/08/20 16:26
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from web 2019/08/21 21:46
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 北海道のブランド食器買取 2019/08/25 01:26
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from web 2019/08/25 04:29
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from bouppteckning 2019/08/26 09:12
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Link Alternatif Rahasiaqq 2019/08/27 11:51
Delete
Neoways의 막나가는 분자생물학
-
Tracked from web page 2019/08/28 02:46
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from agen m8bet 2019/08/29 01:04
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from web 2019/08/30 22:50
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from web 2019/08/31 04:13
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 熊本県のウェッジウッド買取の情報 2019/09/01 07:47
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from web 2019/09/01 10:16
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from pasarqq 2019/09/01 14:22
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from situs judi online online tercepat 2019/09/01 21:53
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from web 2019/09/01 22:56
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from web 2019/09/02 02:57
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from web 2019/09/02 11:13
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Domino Online 2019/09/03 06:56
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from nonton anime subtitle indonesia 2019/09/03 09:13
Delete
Neoways의 막나가는 분자생물학
-
Tracked from web 2019/09/04 02:48
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from unsplash.com 2019/09/04 05:07
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from web 2019/09/05 10:44
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from lucid air renegade 2019/09/05 21:50
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from top affordable hosting 2019/09/07 14:38
Delete
Neoways의 막나가는 분자생물학
-
Tracked from 고스톱 2019/09/10 03:21
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 부천오피 2019/09/11 01:49
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 대구오피 2019/09/11 19:34
Delete
Neoways의 막나가는 분자생물학
-
Tracked from togel sd online 2019/09/12 22:54
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from コールマンなら 2019/09/16 09:40
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 살빼는방법 2019/09/16 10:54
Delete
Neoways의 막나가는 분자생물학
-
Tracked from 富山県の発送代行業者 2019/09/18 06:21
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Kickass 2019/09/18 16:52
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Fortnite Hacks 2019/09/18 23:38
Delete
Neoways의 막나가는 분자생물학
-
Tracked from singapore togel 4d 2019/09/19 22:02
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Agen bola 2019/09/20 14:22
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Zapatos y Bototos hechos en Chile 2019/09/21 14:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://bababest.com 2019/09/21 18:57
Delete
Neoways의 막나가는 분자생물학
-
Tracked from togel nomor 2019/09/22 11:24
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Casino cript with open sourcecode and real money gambling option 2019/09/22 12:10
Delete
Neoways의 막나가는 분자생물학
-
Tracked from fortnite hack 2019/09/22 23:02
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Situs judi bola 2019/09/23 19:10
Delete
Neoways의 막나가는 분자생물학
-
Tracked from bandarq online Indonesia 2019/09/24 16:57
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Situs Judi Qq Online Terpercaya 2019/09/25 20:42
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Domino Online Indonesia 2019/09/25 23:33
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 구미출장안마 2019/09/26 00:20
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from poor radio reception 2019/09/26 01:22
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Manila 2019/09/26 09:43
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from deposit dominoqq 2019/09/28 11:34
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Fortnite Hacks 2019/09/29 07:03
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Domino99 Online 2019/09/30 09:57
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://live.24liveblog.com/live/2356073355923187484 2019/10/01 04:51
Delete
Neoways의 막나가는 분자생물학
-
Tracked from resume vs cv example 2019/10/01 11:48
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from daftar domino qq 2019/10/01 17:49
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from agen bola 24 jam 2019/10/06 07:54
Delete
Neoways의 막나가는 분자생물학
-
Tracked from fortnite hack 2019/10/06 18:53
Delete
Neoways의 막나가는 분자생물학
-
Tracked from 먹튀 2019/10/07 00:25
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Asics Outlet UK 2019/10/09 00:10
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Fortnite Cheat 2019/10/10 00:53
Delete
Neoways의 막나가는 분자생물학
-
Tracked from fortnite aimbot 2019/10/13 02:50
Delete
Neoways의 막나가는 분자생물학
-
Tracked from bandarq Online terpopuler 2019/10/13 05:27
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from my explanation 2019/10/13 17:14
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Fortnite CHEAT Free Downloa 2019/10/13 18:35
Delete
Neoways의 막나가는 분자생물학
-
Tracked from togel singapura yang akan keluar hari ini 2019/10/14 04:22
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from grammy 2019/10/14 05:50
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Web Hosting Services 2019/10/21 03:54
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from sport news twitter 2019/10/25 11:39
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from cosplay costumes 2019/10/26 18:36
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Fortnite Wallhack 2019/10/28 00:54
Delete
Neoways의 막나가는 분자생물학
-
Tracked from fortnite hack 2019/10/28 18:40
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Fortnite Cheat 2019/10/30 08:07
Delete
Neoways의 막나가는 분자생물학
-
Tracked from upgrading the speakers 2019/10/30 16:13
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from XOSLOT69 2019/11/01 11:32
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from www.mobile-audio.eu 2019/11/04 08:01
Delete
Neoways의 막나가는 분자생물학
-
Tracked from the newest features 2019/11/07 22:27
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from situs poker deposit Pulsa 2019/11/08 10:22
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://www.serbubet.Com/ 2019/11/08 16:45
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Fortnite Wallhack 2019/11/09 02:15
Delete
Neoways의 막나가는 분자생물학
-
Tracked from 明星百科 2019/11/10 05:26
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Lautsprecher für VW 2019/11/12 04:02
Delete
Neoways의 막나가는 분자생물학
-
Tracked from brunch n lunch 2019/11/12 20:05
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from หวย 2019/11/15 09:57
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from pelisplus 2019/11/16 09:41
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from crypto currency exchange 2019/11/17 12:02
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from spotify 2019/11/17 22:25
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Nova Luxe Reviews 2019/11/21 01:14
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from condensing oil boiler prices 2019/11/22 06:19
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Enhanced Keto Fuel Pills 2019/11/22 16:55
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from BB Plumbing & Heating 2019/11/22 18:01
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from dewa poker 2019/11/23 04:05
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Mini Creditos Urgentes Sin Nomina 2019/11/23 04:06
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Venclexta Venetoclax 2019/11/25 22:02
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 호텔카지노 2019/11/27 08:38
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from everyonedoesit uk 2019/12/03 02:24
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from pipes 2019/12/06 15:40
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from cosplay costumes 2019/12/08 06:31
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from cosplay costumes 2019/12/08 15:40
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from anchortext 2019/12/09 04:21
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from anchortext 2019/12/09 20:01
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Fortnite CHEAT Free Downloa 2019/12/10 10:43
Delete
Neoways의 막나가는 분자생물학
-
Tracked from www.pocsimplotcu.com. pocsimplotcu.com 2019/12/11 08:00
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from www.netranker.fr 2019/12/11 12:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Fortnite Cheat 2019/12/11 14:51
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Fortnite CHEAT Free Downloa 2019/12/12 01:36
Delete
Neoways의 막나가는 분자생물학
-
Tracked from http://wonderfullketo.org/ 2019/12/12 07:42
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from TruBliss Pure CBD 2019/12/12 09:18
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from roofer Bernalillo 2019/12/12 12:00
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from anchortext 2019/12/12 20:35
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Fortnite Hacks 2019/12/12 22:12
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Baby Clothing Au 2019/12/13 00:26
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from cosplay costumes 2019/12/13 06:00
Delete
Neoways의 막나가는 분자생물학
-
Tracked from http://trkurl.us/leanboostreview48243~s 2019/12/13 11:45
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from fortnite free v bucks generator 2019/12/13 13:36
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from situs Slot freebet Tanpa deposit 2019/12/13 13:46
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Free Video Game Sample Pack 2019/12/13 15:02
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from dentist hornsby 2019/12/13 16:28
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://www.michaelkorsoutlets.xyz/ 2019/12/13 20:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from anchortext 2019/12/13 23:01
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from lubin 2019/12/13 23:25
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Streaming Jav 2019/12/14 02:41
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from percolator bong 2019/12/14 23:13
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from apoteca.udenar.edu.co 2019/12/15 11:57
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Emt Crash Course Free Download 2019/12/15 18:40
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from bandar agen taruhan judi bola 2019/12/15 20:41
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Fortnite Hack Free Downloa 2019/12/15 22:33
Delete
Neoways의 막나가는 분자생물학
-
Tracked from slot depo Pulsa 2019/12/15 22:34
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Qiu Qiu Online 2019/12/16 08:47
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Main Slot Pakai Pulsa 2019/12/16 12:14
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from افلام ايجى بيست 2019/12/16 16:49
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from مشاهدة فيلم Dolittle 2020 مترجم 2019/12/16 16:51
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from situs judi online 2019/12/16 21:27
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from cheap football jerseys free shipping 2019/12/17 02:36
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from acheter des streams 2019/12/17 04:29
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from cosplay costumes 2019/12/17 11:00
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Kode referal bandarq 2019/12/17 22:26
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Enhanced Keto Fuel 2019/12/18 01:03
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Fortnite Hacks 2019/12/18 03:00
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Simplish iOS 2019/12/18 06:23
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from GMX Male Enhancement 2019/12/18 07:50
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Fortnite CHEAT Free Downloa 2019/12/18 09:13
Delete
Neoways의 막나가는 분자생물학
-
Tracked from cosplay costumes 2019/12/18 11:37
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from lubin 2019/12/18 14:24
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 무료바다이야기 2019/12/18 16:26
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from visit this site right here 2019/12/18 18:46
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from pjspawnplus 2019/12/18 19:05
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from No togel 2019/12/19 02:45
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://nkolele.co.za/?option=com_k2&view=itemlist&task=user&id=661636 2019/12/19 06:33
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 바카라사이트 2019/12/19 06:56
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from cosplay costumes 2019/12/19 13:11
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Fortnite Cheat 2019/12/19 16:03
Delete
Neoways의 막나가는 분자생물학
-
Tracked from cosplay costumes 2019/12/20 00:23
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from the fast and the furious egybest 2019/12/20 05:54
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Video production Darlington 2019/12/20 05:57
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://higo.vn/san-pham/vach-ngan-ve-sinh-gia-re-nhat-thi-truong-hien-nay.html 2019/12/20 05:59
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from cosplay costumes 2019/12/20 09:44
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from cosplay costumes 2019/12/20 15:32
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from vach ngan ve sinh 2019/12/20 17:58
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from samsung note 10 plus cases 2019/12/20 18:40
Delete
Neoways의 막나가는 분자생물학
-
Tracked from iphone 11 cases 2019/12/20 18:58
Delete
Neoways의 막나가는 분자생물학
-
Tracked from cosplay costumes 2019/12/21 10:05
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://beatsoup.net 2019/12/21 23:45
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Qq Online 2019/12/22 13:53
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from cosplay costumes 2019/12/22 17:36
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from horoscopo gratis 2019/12/22 21:31
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from agen judi bola online 2019/12/23 11:40
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Situs judi domino online indonesia 2019/12/23 13:23
Delete
Neoways의 막나가는 분자생물학
-
Tracked from DỊCH TIẾNG ĐAN MẠCH 2019/12/24 12:18
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from fortnite aimbot 2019/12/24 14:09
Delete
Neoways의 막나가는 분자생물학
-
Tracked from schooling in their desired Closwithin justgs san mateo Detro 2019/12/25 12:31
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from digital marketing 2019/12/25 18:49
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Best CBD Gummies 2019/12/25 21:00
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Fortnite esp 2019/12/25 23:14
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Agen poker bandar66 judi bandarq sakong online rgosakong 2019/12/26 08:13
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Pkv Games 2019/12/26 14:42
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 그래프사이트 2019/12/26 23:16
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from pawnemporiumllc 2019/12/27 05:21
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Situs Poker Online 2019/12/28 18:44
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Best CBD Gummies 2019/12/28 18:50
Delete
Neoways의 막나가는 분자생물학
-
Tracked from dịch tiếng hàn chính xác 2019/12/30 05:33
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from poker gampang Menang 2019/12/30 09:49
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Freebet Gratis Tanpa Deposit 2019/12/31 07:23
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 강남역안마 2019/12/31 11:45
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Situs Judi poker 2020/01/02 17:53
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Qq Poker 2020/01/04 10:36
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from window cleaning services maole ridge 2020/01/05 00:06
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from carpet protection film 2020/01/05 00:48
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from SF 180 Brain 2020/01/05 03:38
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from raja judi online 2020/01/05 04:47
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from cosplay costumes 2020/01/08 18:29
Delete
Neoways의 막나가는 분자생물학
-
Tracked from bola168 2020/01/10 01:18
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from fortnite aimbot 2020/01/10 09:38
Delete
Neoways의 막나가는 분자생물학
-
Tracked from cosplay costumes 2020/01/11 20:09
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from cosplay costumes 2020/01/15 23:25
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from GreenLyfe Fields Keto 2020/01/16 15:55
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from What is the cost of a car and driver in Sri Lanka in 2020? 2020/01/17 04:29
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from a plus certification classes 2020/01/17 05:46
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Thrust Rx 2020/01/17 09:25
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from greek sandals handmade 2020/01/17 09:26
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Dukun Pelet 2020/01/17 09:51
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from InvisiBeats Earbuds 2020/01/20 00:05
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Skin Bliss Cream Price 2020/01/20 09:00
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from furry-paws.com 2020/01/21 12:59
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Nike Clearance UK 2020/01/23 02:13
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 광주출장 2020/01/24 05:12
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from corporate consulting 2020/01/26 18:44
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://ojodu.com/user/profile/3240096 2020/01/30 09:06
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 레깅스룸 2020/01/30 09:30
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from togel singapore 2020/01/30 11:28
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from mobile trick 2020/01/31 02:43
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Casino 2020/02/01 12:44
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Fortnite esp 2020/02/03 07:35
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Judi slot frog 2020/02/05 07:25
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from m88 2020/02/12 04:43
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Proxy site 2020/02/17 10:58
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Qq online 2020/02/21 05:39
Delete
Neoways의 막나가는 분자생물학
-
Tracked from plumbershelp 2020/02/23 20:41
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from check out this one from D 5066yypb Preview Infomaniak 2020/02/25 03:49
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from livechat poker 2020/02/25 12:10
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from idn poker 2020/02/25 13:04
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from baru-judi-60.webself.net 2020/02/26 00:59
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Judi Online 2020/02/27 06:57
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Quit Smoking - natural And Natural Treatment 2020/02/28 05:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Lash Energizer Review - Grow And Thicken Your Lashes! | Special Offer 2020/02/28 07:33
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Colorado Hemp Farms CBD Oil 2020/02/28 08:02
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 레깅스룸 2020/02/28 08:10
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Jump Start CBD Oil - Ease Your Body And Mind Naturally! | Special Offer 2020/02/28 12:36
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://keto-t911.net/ 2020/02/28 13:59
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Agen Togel Online 2020/02/29 06:03
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Perang Baccarat 2020/03/01 00:49
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://purefecthemp.org/ 2020/03/01 04:57
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://keto-t911.org/ 2020/03/01 06:48
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Lash Energizer Serum 2020/03/01 08:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Up In Smoke: Will President Obama Finally Deliver On Cannabis Campaign. 2020/03/01 09:27
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Arouza Ultimate Male Enhancement 2020/03/01 09:30
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from www.gamebwiki.com explains 2020/03/02 00:48
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from pokeridola.strikingly.com 2020/03/02 12:34
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from กิน royal jelly ตอนไหน 2020/03/02 13:28
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://lvl10cbd.com/ 2020/03/02 14:32
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from best design website Carrollton 2020/03/02 15:26
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from helpful resources 2020/03/02 17:16
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Maxx Libido Reviews 2020/03/02 17:39
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://neurocyclinbrain.com/ 2020/03/03 05:06
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://neurocyclinbrain.com/ 2020/03/03 05:27
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Best CBD Oil 2020/03/03 06:43
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://timelessketoboost.org/ 2020/03/03 10:14
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from roblox script executor 2020/03/03 10:41
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://keto360slimdiet.com/ 2020/03/04 00:12
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Green Alert CBD Reviews 2020/03/04 01:52
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 더킹카지노 2020/03/04 06:49
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from new post from thinzoneketo.net 2020/03/04 08:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://thinzoneketo.com/ 2020/03/04 08:26
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from livechat poker 2020/03/04 08:59
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from QProfit System Reviews 2020/03/05 01:21
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Natural Pharma CBD Oil Reviews 2020/03/05 04:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Well Tonic CBD Reviews 2020/03/05 04:29
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from nashville used car dealerships 2020/03/05 04:35
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Leaf Place CBD Review 2020/03/06 01:02
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Avionella Cream 2020/03/06 02:04
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://forestleafworks.com/ 2020/03/06 05:50
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Safe Guard CBD 2020/03/06 07:09
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from QProfit System 2020/03/07 01:24
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Snow Teeth Whitening System 2020/03/07 01:38
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Instant Boost Brain Reviews 2020/03/07 06:17
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from The Weekday Plan belonging To The Cyclical Ketogenic Diet 2020/03/07 06:54
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Keto 360 Slim Reviews 2020/03/08 00:22
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Try Glamour Reviews 2020/03/08 03:52
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://hypedropscbd.com/ 2020/03/08 05:56
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from White Peony Serum Reviews 2020/03/08 06:04
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://nuluxecream.com/ 2020/03/08 06:26
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Hydressence Serum Price 2020/03/09 00:26
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Alpha X Men Male Enhancement 2020/03/09 05:35
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Avionella Cream 2020/03/09 06:06
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://welltoniccbd.net/ 2020/03/10 00:25
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Avionella Cream 2020/03/10 00:49
Delete
Neoways의 막나가는 분자생물학
-
Tracked from http://claudiobaylee368.pen.io/ 2020/03/10 01:46
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Keto Burn XXX 2020/03/10 01:56
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Natural Pharma CBD Reviews 2020/03/10 02:29
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Slim Fast Keto Max Reviews 2020/03/10 02:32
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Twinkle Radiance 2020/03/10 02:33
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Keto / Ketosis / Ketogenic: Diet And Nutrition 2020/03/10 02:49
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Consistent Basic Skin Care - Achieve Good Looking Skin 2020/03/10 03:36
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://slimphoria.org/ 2020/03/11 00:28
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from MaleX Male Enhancement Pills 2020/03/11 04:01
Delete
Neoways의 막나가는 분자생물학
-
Tracked from click through the following website 2020/03/13 02:34
Delete
Neoways의 막나가는 분자생물학
-
Tracked from cum 2020/03/13 02:59
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from HealCBD Review 2020/03/13 03:15
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from agen judi slot deposit Pulsa 2020/03/13 04:32
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from situs judi slot indonesia 2020/03/13 04:46
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://nrg99.org/ 2020/03/14 00:15
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Diet Clarity Keto - Torch Fat And Boost Metabolism Naturally! | Review 2020/03/14 02:27
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Grow Organic Cannabis 2020/03/14 02:29
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://naturesboostbrainbooster.org/ 2020/03/14 03:13
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://neurocyclinbrain.com/ 2020/03/14 03:14
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from read this post from Cannagreencbd 2020/03/15 04:37
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Lean System 7 supplements 2020/03/16 00:04
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from wiki.Cph-software.de 2020/03/16 00:14
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Ultra X Boost Testosterone 2020/03/16 01:12
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Heal CBD - Improve Your Heath Today! | Special Offer! 2020/03/16 01:19
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://timelessketo.com/ 2020/03/16 03:48
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://slimxnatureketo.net/ 2020/03/16 04:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Canna Green CBD Oil - Gummies That Relieve Anxiety / Pain! | Review 2020/03/16 04:16
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Testo Vance Review 2020/03/16 04:16
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Smoking Marijuana And Using Positive Affirmations 2020/03/16 04:44
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from KanaDrops CBD Review 2020/03/17 00:01
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Slim X Nature Keto Review 2020/03/17 02:52
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://luxuriantantiagingcream.com/ 2020/03/17 05:21
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://vividglowserum.com/ 2020/03/18 00:37
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from KanaDrops Reviews 2020/03/18 02:32
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Bitcoin Storm App Website 2020/03/18 03:09
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Ultra X Boost Testosterone - X Out Performance Problems! | Special Offer 2020/03/18 05:23
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Ultra X Boost Testosterone - Better Life in Bed! | Special Offer! 2020/03/18 05:40
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Empowered X Energy - Be A Better Man! | Special Offer! 2020/03/18 07:46
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from No Hype Keto 2020/03/18 08:02
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from agen pkv games 2020/03/18 08:04
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Empowered X Energy Pills 2020/03/18 08:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Timless Keto 2020/03/18 23:59
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Is There A Drug Type individual? 2020/03/19 00:34
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Alpha X Men Male Enhancement Pills 2020/03/19 00:46
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://slimxnatureketo.org/ 2020/03/19 00:52
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Slim X Nature Keto Reviews 2020/03/19 00:58
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from MedCell CBD 2020/03/19 00:59
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Dominoqq Online indonesia 2020/03/19 01:19
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://slimclarity.org/ 2020/03/19 01:34
Delete
Neoways의 막나가는 분자생물학
-
Tracked from How To Acquire A Suitable Soccer Jersey For Yourself 2020/03/19 04:20
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Ultra X Boost Testosterone Reviews 2020/03/19 04:33
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Wellness Ensure Keto Reviews 2020/03/19 04:35
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from p918 2020/03/19 04:42
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Https://Www.Juarabola168.Com/ 2020/03/19 05:52
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://ketoburnxxxdiet.com/ 2020/03/19 06:37
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://slimclarity.org/ 2020/03/20 00:07
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from NeuroCyclin Review 2020/03/20 02:58
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Wellness Ensure Keto Review 2020/03/21 03:16
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Thunder D 2020/03/21 07:04
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Safeguard CBD Oil 2020/03/21 09:31
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Lifeguard Labs CBD 2020/03/21 09:55
Delete
Neoways의 막나가는 분자생물학
-
Tracked from http://wellnessqualities.net/ 2020/03/22 02:42
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from EverJay CBD 2020/03/22 03:13
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://maxstrongxl.com/ 2020/03/22 03:23
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Empowered Energy Testosterone Review 2020/03/22 03:59
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://wellnessensureketo.com/ 2020/03/22 04:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Demore Skin Cream Reviews 2020/03/22 04:15
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://keto360slim.org/ 2020/03/22 05:27
Delete
Neoways의 막나가는 분자생물학
-
Tracked from thuoc tang cuong sinh ly 2020/03/23 11:14
Delete
Neoways의 막나가는 분자생물학
-
Tracked from discuss 2020/03/23 18:24
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Super Chaga Diabetes 2020/03/24 08:46
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from VIP Fuel Keto Reviews 2020/03/24 15:02
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from WT CBD Reviews 2020/03/25 10:21
Delete
Neoways의 막나가는 분자생물학
-
Tracked from testoxp360maleenhancement.com 2020/03/27 03:13
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from N95 Breathe Mask Review 2020/03/27 03:27
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Premium Keto BHB Review 2020/03/27 03:29
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from N95 Breathe Mask Review 2020/03/27 03:37
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Size X Male Enhancement Pills 2020/03/27 03:50
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Fast Slim Keto Diet 2020/03/27 05:43
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://caspariwatch.net/ 2020/03/28 01:41
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from [Https://Www.Bestdrumdeals.Com/|Agen Bola] 2020/03/28 02:18
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Ever Jay CBD Oil 2020/03/28 02:24
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://trimfastketopills.com/ 2020/03/29 05:22
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from xt_blog 2020/03/29 07:20
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Beauty Product Review: Kate Somerville Gentle Daily Wash 2020/03/31 00:48
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Demore Skin Cream 2020/03/31 01:11
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Caspari Watch Price 2020/03/31 01:16
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Smart Sanitizer 2020/03/31 01:33
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Vital Wellness CBD Oil Reviews 2020/03/31 01:34
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://slimclarityketo.net/ 2020/03/31 02:11
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Ad Flippers Bot Reviews 2020/04/01 02:58
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Lavita CBD - Live A Healthier Life With Hemp Oil! | Special Offer 2020/04/01 03:31
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from rahasiacasino88.mystrikingly.com 2020/04/01 03:37
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from InfinitiKloud SD USB Stick - Save 50% & Protect Your Photos! | Review 2020/04/01 04:09
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Advanced Dietary Keto 2020/04/02 00:00
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Knights Keto Price 2020/04/02 01:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Ultra Boost Keto Side Effects 2020/04/02 04:04
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Twisted Cell Testo 2020/04/02 06:21
Delete
Neoways의 막나가는 분자생물학
-
Tracked from https://n95breathesafe.com/ 2020/04/02 06:22
Delete
Neoways의 막나가는 분자생물학
-
Tracked from http://infinitikloudsd.com/ 2020/04/03 01:06
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from pm milestone 2020/04/03 03:32
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Keto BHB Fast Reviews 2020/04/04 02:11
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Safe Mask Pro 5 Review 2020/04/05 00:32
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Twisted Cell - Improve Your Bedroom Tonight! | Special Offer! 2020/04/05 02:05
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Ultra Boost Keto - Boost Your Weight Loss | Special Offer! 2020/04/05 02:34
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Empowered Energy Testosterone Booster 2020/04/05 03:06
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://erectizyte.org/ 2020/04/05 03:14
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://vitalimmunesupport.org/ 2020/04/05 03:19
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Get More Information 2020/04/05 05:47
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from CannBio CBD - Make Your Health More Natural! | Special Offer! 2020/04/05 06:18
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://ketotrek.net/ 2020/04/06 00:14
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Check Out Youthrenew 2020/04/06 01:31
Delete
Neoways의 막나가는 분자생물학
-
Tracked from CannBio CBD 2020/04/06 05:37
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://naturalpureketoreview.com/ 2020/04/07 04:20
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Raging Leo Male Enhancement 2020/04/08 06:48
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Total Defense Immunity Blend Oil 2020/04/09 00:00
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from The Spark Male Enhancement Review 2020/04/09 00:49
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://premiumketobhb.net/ 2020/04/09 00:50
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Puri Glow Reviews 2020/04/10 00:11
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Hardcore Ketogenic Diet Trim 2020/04/10 02:22
Delete
Neoways의 막나가는 분자생물학
-
Tracked from http://testoxp360.net/ 2020/04/10 02:32
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 경산출장안마 2020/04/10 23:59
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Cylophin Rx Male Enhancement 2020/04/11 03:49
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Organna Leaf CBD 2020/04/11 04:11
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Slim Clarity Review 2020/04/11 04:16
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from OrgannaLeaf CBD Review 2020/04/11 04:20
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://cleanersmile.org/ 2020/04/12 00:27
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Cleaner Smile Review 2020/04/12 00:28
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from OS JetPods V3 2020/04/12 00:30
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from OS JetPods Reviews 2020/04/12 00:44
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from HealthOxide Keto 2020/04/12 00:54
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from True Keto Boost 2020/04/12 01:55
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Cleaner Smile Reviews 2020/04/13 00:15
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://cleanersmile.org/ 2020/04/13 00:27
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://vigofirm.com/ 2020/04/13 00:29
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Cleaner Smile Whitening Pen Review 2020/04/13 02:16
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Cleaner Smile 2020/04/13 02:27
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Cleaner Smile Reviews 2020/04/13 02:28
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Cylophin Rx - Last Longer In The Bedroom! | Special Offer 2020/04/13 23:59
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from BreatheX Pro Review 2020/04/14 00:03
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Immunity Shield Review 2020/04/14 00:41
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Immunity Shield Reviews 2020/04/14 00:46
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Keto Now Real Pills 2020/04/14 01:06
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://slimxnatureketo.net/ 2020/04/14 01:50
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Cylophin Rx Reviews 2020/04/14 01:51
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Keto BHB Pills Review 2020/04/14 02:40
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Bio X Mask Review 2020/04/15 01:17
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from BreatheX Pro Reviews 2020/04/15 02:00
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from BreatheX Pro Review 2020/04/15 02:05
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Empowered X Testosterone Reviews 2020/04/15 02:15
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 2X Vitality Keto Pills 2020/04/16 00:44
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from BreatheX Pro Review 2020/04/16 01:20
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Keto Bodz Review 2020/04/17 01:14
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://slimclarity.org/ 2020/04/17 01:56
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Keto Now Real 2020/04/17 01:57
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from De Lissa 2020/04/18 00:42
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from InfinitiKloud USB Stick 2020/04/18 00:43
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://organiclabscbd.org/ 2020/04/18 01:59
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Demore Skin Cream 2020/04/18 02:09
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://ketogenetic.net/ 2020/04/19 00:49
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Embella Cream 2020/04/19 00:55
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Pandemic Survival Kit List 2020/04/19 02:00
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Pandemic Survival Kit List 2020/04/19 02:07
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Pandemic Survival Kit 2020/04/19 02:09
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://pandemicsurvivalkit.org 2020/04/19 02:11
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Demore Skin Cream Review 2020/04/20 00:00
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Nature Blend Keto 2020/04/20 00:05
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Vigor Smart Reviews 2020/04/20 00:47
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Xialis Rx Review 2020/04/20 01:22
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from NeoLyfe Reviews 2020/04/20 01:33
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from GRN CBD 2020/04/20 01:45
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Neo Lyfe Keto Review 2020/04/20 02:00
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from KN95 Reusable Breathing Mask 2020/04/21 00:04
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://kn95reusablemask.com/ 2020/04/21 00:10
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://kn95reusablemask.com/ 2020/04/21 00:11
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from KN95 Reusable Mask Review 2020/04/21 00:13
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Slim X Nature Keto 2020/04/21 02:22
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from qiu Online 2020/04/23 00:14
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from And Virility! | Special Offer 2020/04/23 01:15
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Max Force Keto Review 2020/04/23 01:17
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Slim X Keto Reviews 2020/04/23 01:21
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Nature Blend Keto 2020/04/23 02:05
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Elite Keto Slim 2020/04/23 02:25
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://ketobhbpills.net/ 2020/04/24 05:59
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Perfect Origins Keto XO Review 2020/04/24 07:43
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://slimclarity.net/ 2020/04/24 07:46
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://pureluxecream.net/ 2020/04/24 07:50
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://ragingleo.com/ 2020/04/24 07:52
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://pureluxecream.net/ 2020/04/24 07:52
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://slimclarity.net/ 2020/04/24 08:01
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://provitra.org/ 2020/04/25 00:16
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://provitra.org/ 2020/04/25 00:27
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://nutraslimketo.org/ 2020/04/25 00:35
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Slim X Nature Keto Review 2020/04/25 00:37
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://perfectoriginsketo.com/ 2020/04/25 01:25
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://perfectoriginsketo.com/ 2020/04/25 01:27
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://pureluxecream.net/ 2020/04/25 01:30
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Slim Clarity Review 2020/04/25 01:34
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Slim Clarity Keto Review 2020/04/25 01:35
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Hemp Max Lab 2020/04/26 03:13
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://immunityshield.org/ 2020/04/26 04:11
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Natural Pure Keto 2020/04/26 04:16
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://ragingleo.org/ 2020/04/26 04:20
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://osjetpods.com/ 2020/04/27 02:53
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://ovecream.net/ 2020/04/27 05:23
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://ovecream.net/ 2020/04/27 05:25
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Missa Derma Care Review 2020/04/27 05:39
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://slimclarity.net/ 2020/04/28 01:36
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from family sex 2020/04/28 05:00
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from American Shaman CBD Oil 2020/04/28 05:45
Delete
Neoways의 막나가는 분자생물학
-
Tracked from http://ketonutraslim.net/ 2020/04/29 02:57
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://ketonutraslim.net/ 2020/04/29 03:03
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://ketonutraslim.net/ 2020/04/29 03:12
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Luma Clear - Illuminate Your Skin And Reduce Wrinkles! | Special Offer 2020/04/29 03:38
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Arouza Ultimate Male Enhancement 2020/04/29 03:56
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 2X Vitality Keto Diet 2020/04/29 04:14
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Marley Spoon Meals This Week 2020/04/30 00:38
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from True Keto Sample Review 2020/04/30 00:52
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://primedmaleenhancement.com/ 2020/04/30 01:04
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from VividGlow Cream 2020/04/30 02:48
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Crystalene Skin Cream 2020/04/30 04:13
Delete
Neoways의 막나가는 분자생물학
-
Tracked from http://immunitydefensexr.org/ 2020/05/01 03:37
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from mouse click the up coming document 2020/05/01 03:54
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Number One Keto 2020/05/01 04:28
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Crystalene Skin Cream Reviews 2020/05/01 04:28
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Pandemic Survival Kit 2020/05/02 00:26
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://grncbd.org/ 2020/05/02 01:00
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Keto Core Max Reviews 2020/05/03 01:25
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://vitalimmunesupport.org/ 2020/05/03 02:52
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Vital Immune Support Ingredients 2020/05/03 02:55
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Vital Immune Support 2020/05/03 02:57
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Vital Immune Support Review 2020/05/03 03:00
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://vitalimmunesupport.org/ 2020/05/03 03:02
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Number One Keto 2020/05/03 03:03
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Vital Immune Support Ingredients 2020/05/03 03:03
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Number One Keto Pills 2020/05/04 00:33
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Youth Renew Cream - Better Skin Today! | Special Offer! 2020/05/05 00:34
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://eternalamorecream.com/ 2020/05/05 00:38
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Youth Renew Cream 2020/05/05 00:46
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://maxprimemaleenhancement.com/ 2020/05/06 04:12
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from LumaClear Skin Serum Review 2020/05/06 11:15
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://artmight.com/user/profile/67474 2020/05/07 16:37
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Vital Immune Support Ingredients 2020/05/07 19:21
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Luxuriant Cream 2020/05/07 19:29
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Natural Pure Keto Ingredients 2020/05/08 02:22
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://sparkmaleenhancement.net/ 2020/05/08 02:45
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from State Side CBD 2020/05/08 03:02
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from StateSide CBD 2020/05/08 03:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from SuperSonic Keto 2020/05/09 00:47
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Instant Immune Review 2020/05/09 07:13
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Javelin Male Enhancement 2020/05/10 00:33
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://sparkmaleenhancement.com/ 2020/05/10 06:02
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Crystalene Skin Reviews 2020/05/11 03:29
Delete
Neoways의 막나가는 분자생물학
-
Tracked from BioViderma Eye Serum 2020/05/13 01:54
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from FX Vital Immunity 2020/05/13 05:14
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Voyager Keto Pills 2020/05/13 08:48
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Cylophin Rx Male Enhancement 2020/05/14 02:00
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 2X Vitality Keto Diet 2020/05/14 02:11
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://vigofirmmax.net/ 2020/05/14 02:19
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://breathesafemask.org/ 2020/05/14 03:12
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Organic Recover CBD Oil Review 2020/05/14 05:52
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from zberindcbd.net 2020/05/15 01:16
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Zberind Full Spectrum CBD 2020/05/15 01:33
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from CleaniX UV Light 2020/05/15 01:43
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Aspen Hemp CBD Oil Review 2020/05/15 01:48
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Zberind CBD Oil 2020/05/15 01:57
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from VitalFlow Review 2020/05/16 00:48
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Pure Immunity Blend Reviews 2020/05/16 02:10
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Pure Immunity Blend Essential Oil 2020/05/16 02:11
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from liquor 2020/05/16 03:27
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://pureimmunityblend.org/ 2020/05/16 08:07
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from TruVirility Pills - The #1 Performance Support Pill Is Here! | Review 2020/05/17 02:52
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://vitalflowprostate.net/ 2020/05/17 04:23
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://ketopills.net/review/f-burn-plus-keto/ 2020/05/17 05:26
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://pureimmunityblend.org/ 2020/05/17 05:59
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Defense Shield Pro 2020/05/17 07:22
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Cylophin Rx Reviews 2020/05/18 09:10
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from BioViderma Reviews 2020/05/19 05:27
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Nutri Fix Keto Diet 2020/05/19 08:16
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from KetoFrame 2020/05/20 06:23
Delete
Neoways의 막나가는 분자생물학
-
Tracked from KetoFrame 2020/05/20 08:33
Delete
Neoways의 막나가는 분자생물학
-
Tracked from BioViderma Serum 2020/05/21 03:35
Delete
Neoways의 막나가는 분자생물학
-
Tracked from AgeDefy Review 2020/05/21 05:28
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Keravita Pro Review 2020/05/22 06:31
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Prime X Factor Muscle Reviews 2020/05/23 00:45
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Prime X Factor Muscle Review 2020/05/23 00:47
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Sterilize-X 2020/05/23 01:19
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 에볼루션카지노 2020/05/25 03:11
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://nanocbdpatch.net/ 2020/05/25 12:05
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Pulse Mini Pods Review 2020/05/26 05:14
Delete
Neoways의 막나가는 분자생물학
-
Tracked from FX Vital Immunity Booster 2020/05/27 09:45
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://starkstamina.org/ 2020/05/27 10:41
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from bioviderma 2020/05/27 11:45
Delete
Neoways의 막나가는 분자생물학
-
Tracked from http://ecotecenergysaver.com/ 2020/05/27 13:07
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from dominoqq 2020/05/30 17:13
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://harfordcontrol.qhub.com/member/1587279 2020/06/03 06:56
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://www.everythingbirds.com/community/users/sungmenendez5/ 2020/06/03 07:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Скачать через браузер 2020/06/03 07:09
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://www.post-freeads.co.uk/user/profile/24202 2020/06/03 07:15
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from PureLuxe Eye Cream Price 2020/06/03 07:20
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://ketopills.net/review/diet-pills/befit-keto-cut/ 2020/06/03 07:32
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Merry Christmas 2020/06/03 07:43
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://engeena.com/component/k2/itemlist/user/174619 2020/06/03 07:44
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from BriteBelle Reviews 2020/06/03 07:51
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://www.johnsonclassifieds.com/user/profile/1176939 2020/06/03 08:09
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from http://freebusinessadvertising.freeglobalclassifiedads.com/user/profile/10659 2020/06/03 08:11
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Back to Project List 2020/06/03 08:28
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from اینجا(+) 2020/06/03 09:33
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://maricannarxcbd.net/ 2020/06/03 10:46
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Hydra Cort Reviews 2020/06/06 07:45
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from کلیک کنید 2020/06/07 07:03
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Happy Honey Serum Price 2020/06/19 09:34
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Simple Keto 2020/06/19 09:54
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Biosource Wellness Keto Reviews 2020/06/19 10:41
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from www.musical-Instrument.online 2020/06/19 11:10
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from HRD Surge Premium Male Enhancement 2020/06/20 00:52
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Hydra-E Face Cream 2020/06/20 01:17
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Truvalast Reviews 2020/06/20 02:31
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Biosource Wellness Keto 2020/06/20 03:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Apex Alpha Male Enhancement Pills 2020/06/22 10:06
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Simple Keto Burn Review 2020/06/24 02:07
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Optimum Advance Keto Review 2020/06/25 04:35
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Bandar Bola 2020/06/26 01:25
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Max Plus Male Enhancement Review 2020/07/22 01:22
Delete
Neoways의 막나가는 분자생물학
-
Tracked from releaselog 2020/07/22 02:50
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Graduated copper compression socks 2020/07/22 04:45
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Judi bola online 2020/07/22 04:58
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://radiofree.wiki/ 2020/07/22 05:11
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Max Plus Male Enhancement Pills 2020/07/22 07:26
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Super Slim Keto Ingredients 2020/07/25 13:47
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from daftar poker online 2020/07/26 09:25
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Painting needs seriously 2020/07/26 09:39
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from voile splitboard bindings 2020/07/26 10:18
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Rapid Relief CBD Oil Review 2020/07/29 11:20
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Rapid Relief CBD Oil Price 2020/07/29 11:27
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Total Body Keto 2020/07/30 03:10
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from G.O.A.Testo Reviews 2020/07/30 06:01
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Sarkhani Keto Ketogenic Diet Support 2020/08/20 04:26
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Daftar Poker Online 2020/08/20 04:38
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from SuperCharge Keto BHB Review 2020/08/20 05:38
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 선릉역안마 2020/08/20 06:43
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from こちらをクリック 2020/08/31 07:28
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Ulera Skin Serum 2020/08/31 08:45
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Colossus DX Pills 2020/08/31 09:51
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from BookProfits Program 2020/09/01 01:11
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from lihat disini 2020/09/01 02:45
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from judi bola Terpercaya 2020/09/01 13:51
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from bandar bola Online 2020/10/05 15:50
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Biotech Quick Trim Pro Keto 2020/10/08 15:48
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://biotechketo.com/ 2020/10/08 19:38
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Biotech Quick Trim Pro Keto 2020/10/08 21:18
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Lavish Grace Skin Care Review 2020/10/08 21:43
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Magnum Rock Male Enhancer 2020/10/09 01:12
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from pipedream dolls uk 2020/11/06 11:43
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Mars777 2020/11/09 23:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from สล็อต 2020/11/13 13:06
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from modern crib bedding sets 2020/11/14 06:31
Delete
Neoways의 막나가는 분자생물학
-
Tracked from TinoHouse 2020/11/14 17:45
Delete
Neoways의 막나가는 분자생물학
-
Tracked from paisley bedding 2020/11/15 17:31
Delete
Neoways의 막나가는 분자생물학
-
Tracked from royal jelly cream รีวิว 2020/11/15 19:52
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Drinks After Work (song) 2020/11/23 04:21
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from drink in spanish translation 2020/11/25 01:55
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from poppers uk 2020/11/26 22:25
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Dewi365 2020/11/27 19:20
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from agen slot habanero 2020/12/03 00:44
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from ขาย อะไร ใน ไอ จี ดี 2020/12/07 04:00
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 역삼안마방 2020/12/07 07:03
Delete
Neoways의 막나가는 분자생물학
-
Tracked from 역삼안마방 2020/12/07 12:36
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Samsung Robot Vacumn Swivel Wheel With Springs and Screws CycloneForce Powerbot 2020/12/17 08:14
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Harry Potter Quiz 2020/12/18 03:46
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 리뷰 보고 쇼핑 쿠팡 리뷰 2020/12/24 02:04
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 토토 메이저 2020/12/24 23:16
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 출장마사지 2020/12/25 02:02
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Read Cenforcetop 2020/12/27 12:26
Delete
Neoways의 막나가는 분자생물학
-
Tracked from world news 2020/12/28 14:20
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Maral Gel 2021/01/01 10:32
Delete
Neoways의 막나가는 분자생물학
-
Tracked from 2021/01/02 11:43
Delete
Neoways의 막나가는 분자생물학
-
Tracked from 2021/01/06 03:28
Delete
Neoways의 막나가는 분자생물학
-
Tracked from sữa ensure đức 2021/01/16 06:25
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from titan gel 2021/01/19 13:18
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from sữa tăng cân cho em bé 2021/01/19 15:13
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Fermelique Skin Care 2021/01/20 11:14
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from poker idn 2021/01/26 17:49
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Free Piano Sheet 2021/01/28 00:18
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from judi terpercaya 2021/01/31 14:44
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from kem v7 2021/02/01 05:00
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from đường truyền mạng để livestream 2021/02/02 13:36
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Am Thuc Chay 2021/02/04 11:37
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from ราคาบอลเต็ง 2021/02/05 02:20
Delete
Neoways의 막나가는 분자생물학
-
Tracked from คาสิโน888 2021/02/07 03:12
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Bücher 2021/02/09 07:42
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from ppt 무료 템플릿 2021/02/19 13:25
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from การ์ตูนอนิเมะ รีวิว อนิเมะ 2021/02/24 14:27
Delete
Neoways의 막나가는 분자생물학
-
Tracked from daftar agen poker 2021/02/24 17:42
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from idn poker 2021/02/24 18:52
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from bandar ceme online 2021/02/25 03:10
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from agen slot joker123 2021/02/25 07:20
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from sabung ayam online 2021/02/26 00:10
Delete
Neoways의 막나가는 분자생물학
-
Tracked from situs slot online 2021/02/26 04:32
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from viên sủi giảm cân hami 2021/02/26 09:54
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from drug crime attorney 2021/02/27 03:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from belly busting supplements 2021/02/27 04:15
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from POKER88 2021/03/01 09:58
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from info lebih lengkap 2021/03/02 05:52
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://www.adirs-Bookmarks.win/agen-poker-2020-4 2021/03/03 02:12
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from idn poker 2021/03/03 02:14
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from agen poker 2021/03/03 02:52
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from eczema remedies 2021/03/03 03:49
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from judi online 2021/03/03 04:20
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Togel Terpercaya 2021/03/03 04:20
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from poker 2021/03/03 09:13
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://ovforumnederland.nl/ 2021/03/05 00:06
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from agen poker online Terpercaya 2021/03/05 00:10
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Appvalley Apk Android 2021/03/05 00:12
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Autonomous SmartDesk 2 2021/03/05 03:19
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://www.golf-Bookmarks.win 2021/03/05 03:20
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from glowing skin 2021/03/05 05:20
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from ceme online 2021/03/05 08:19
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from agen togel 2021/03/08 06:57
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from idn play 2021/03/09 01:53
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from อ่านนิยายแปลไทย 2021/03/11 05:33
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from อำนาจ การเมือง 2021/03/11 05:37
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from อ่านนิยายแปลไทย 2021/03/11 07:06
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from custom patches near me 2021/03/11 08:07
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from daftar idn poker|idn poker daftar|daftar idnpoker|idnpoker daftar|cara daftar idn poker|pendaftaran idn poker|daftar akun idn poker|daftar akun idnpoker|daftar idn poker terpercaya|daftar idn poker88|daftar idnpoker88|idn poker88 daftar|idnpoker88 daftar 2021/03/12 00:11
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from custom made patches 2021/03/12 01:51
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Psychic reading 2021/03/12 06:36
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from osg777 2021/03/13 02:55
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from situs poker 2021/03/13 07:25
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Judi Bola 2021/03/15 07:35
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Info lebih lengkap 2021/03/16 05:05
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from schlüsseldienst 2021/03/18 07:13
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from whatsapp gb 2021/03/23 01:39
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from capsa online 2021/03/26 00:00
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from AcuanToday 2021/03/28 04:35
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from pragmatic play 2021/03/28 13:00
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from awl lawsuit 2021/03/30 07:16
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from selengkapnya disini 2021/03/30 10:21
Delete
Neoways의 막나가는 분자생물학
-
Tracked from judi bola 2021/03/31 08:29
Delete
Neoways의 막나가는 분자생물학
-
Tracked from america web loan settlement 2021/04/02 03:57
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Poker Online 2021/04/02 05:41
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from vivoslot.net 2021/04/03 11:26
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from AWL settlement 2021/04/03 12:52
Delete
Neoways의 막나가는 분자생물학
-
Tracked from awl lawsuit 2021/04/03 15:05
Delete
Neoways의 막나가는 분자생물학
-
Tracked from s128.net 2021/04/05 01:11
Delete
Neoways의 막나가는 분자생물학
-
Tracked from info lengkap 2021/04/05 18:24
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from s 128 2021/04/07 02:39
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Deposit pulsa 2021/04/09 01:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://taruhanbol.net/ 2021/04/11 00:43
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from w88 2021/04/14 00:35
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 메이저사이트 2021/04/19 03:37
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from awl settlement 2021/04/19 14:23
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from rb88 2021/04/22 03:44
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from www.alpha-net.ne.jp 2021/04/22 12:09
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from forum.yawfle.com 2021/04/24 03:49
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from situs pkv games 2021/04/25 13:01
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from lifewave patches cost 2021/04/25 14:42
Delete
Neoways의 막나가는 분자생물학
-
Tracked from w88 2021/04/26 05:56
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Poker Online Deposit Pulsa 2021/04/27 04:22
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://go20.supulo.com/index.php?mid=slider_1&document_srl=179837 2021/04/27 08:56
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from please click the up coming document 2021/04/27 09:12
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from slidewiki.org 2021/04/27 09:41
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from AWL settlement 2021/04/27 09:54
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Gematodiatrofi Hua official website 2021/04/27 11:14
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from off white vlone hoodie 2021/04/27 21:05
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from auswell life royal jelly 2021/04/29 02:49
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from AWL settlement 2021/04/29 04:50
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from auswelllife pantip 2021/04/29 09:40
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from hrbusinesslive.com 2021/04/30 02:43
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from situs judi online terbaik 2021/05/01 12:01
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from pkvpoker 2021/05/03 09:18
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Nuubu pflaster erfahrungen 2021/05/05 07:46
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from American web loan settlement 2021/05/05 07:50
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from animals 2021/05/08 05:49
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Black Screen Rain Sounds 2021/05/09 04:33
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 4k 2021/05/10 03:43
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 출장마사지 2021/05/13 01:00
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from cheap psychic readers 2021/05/17 09:47
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from read what he said 2021/05/21 12:44
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from pkvpoker 2021/06/01 07:16
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from klik disini 2021/06/04 04:52
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from situs judi slot online 2021/06/07 16:15
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from informasi selanjutnya 2021/06/08 08:40
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from judi online 2021/06/09 03:16
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 메이저사이트 2021/06/17 12:58
Delete
Neoways의 막나가는 분자생물학
-
Tracked from สมัคร betflix 2021/06/26 07:26
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://maharlikaads.info/index.php?page=user&action=pub_profile&id=930 2021/06/29 16:26
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Cetak map raport 2021/06/29 19:13
Delete
Neoways의 막나가는 분자생물학
-
Tracked from cetak sampul raport jogja 2021/06/29 20:21
Delete
Neoways의 막나가는 분자생물학
-
Tracked from cmd368 2021/07/03 16:49
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Betflix 2021/07/06 03:32
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from daftar pkv 2021/07/07 00:00
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Jnrxflaser.com 2021/07/07 02:09
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from daftar pkv poker 2021/07/07 08:30
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from สมัคร Bpg slot 2021/07/08 03:16
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Habanero Slot Demo 2021/07/10 14:01
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from situs dominoqq 2021/07/14 05:30
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from betflik 2021/07/18 13:40
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from betflix 2021/07/20 07:49
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from betflix 2021/07/29 20:14
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from car accident injury attorney 2021/07/31 02:06
Delete
Neoways의 막나가는 분자생물학
-
Tracked from car accident lawyer near me 2021/07/31 04:30
Delete
Neoways의 막나가는 분자생물학
-
Tracked from www.bookmark-maker.win 2021/07/31 05:26
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Joker123.net 2021/07/31 06:26
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Desi Kahani 2021/08/03 00:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Stump Removal 2021/08/16 05:02
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Tree Service Experts 2021/08/17 05:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Movie2Box 2021/08/24 19:53
Delete
Neoways의 막나가는 분자생물학
-
Tracked from เบทฟิก 2021/08/26 20:23
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from YICHANG 2021/08/28 16:04
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from epublibre net 2021/08/30 13:19
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from idnpoker 2021/08/31 07:10
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from top ten pre workout 2021/09/02 01:41
Delete
Neoways의 막나가는 분자생물학
-
Tracked from protein powder good for teenager 2021/09/05 00:29
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from best protein powder for teen 2021/09/05 00:37
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from best protein powder for teenager boy 2021/09/05 01:09
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 슬롯게임룰 2021/09/06 03:27
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from tree cutting 2021/09/06 05:56
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from best roasted coffee beans 2021/09/07 08:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from deposit Pulsa 2021/09/07 09:55
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from tree service experts 2021/09/08 02:38
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from tree removal 2021/09/08 05:36
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from เบทฟิก 2021/09/08 06:35
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from good whole bean coffee 2021/09/13 02:45
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from best bean coffee brand 2021/09/13 11:22
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from tree service experts 2021/09/16 06:10
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from tree service experts 2021/09/27 05:42
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from traveling tips 2021/10/06 06:20
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from All About Tea Benefits 2021/10/08 04:50
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from betflix 2021/10/08 10:12
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from slotqq 2021/10/09 00:13
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from grandma t-Shirt 2021/10/09 00:38
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Botox Near Me 2021/10/12 03:21
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from removal leads 2021/11/05 00:21
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 오늘뉴스 2021/12/06 03:02
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from พวงหรีด 2021/12/19 01:15
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from cheap milling machine 2021/12/26 12:27
Delete
Neoways의 막나가는 분자생물학
-
Tracked from baby monitors vs security systems 2021/12/28 06:46
Delete
Neoways의 막나가는 분자생물학
-
Tracked from 카빠 강남바카러 서설카지노 카지노바 강원랜드 양방 2021/12/29 00:18
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from negozio di videogiochi 2022/01/06 01:07
Delete
Neoways의 막나가는 분자생물학
-
Tracked from pantaloncini da spiaggia uomo 2022/01/08 12:10
Delete
Neoways의 막나가는 분자생물학
-
Tracked from il pc non riconosce il tablet 2022/01/08 13:48
Delete
Neoways의 막나가는 분자생물학
-
Tracked from wholesale automotive accessories 2022/01/09 03:10
Delete
Neoways의 막나가는 분자생물학
-
Tracked from confronto cellulari 2022/01/09 08:34
Delete
Neoways의 막나가는 분자생물학
-
Tracked from visit Wenalway now >>> 2022/01/18 06:21
Delete
Neoways의 막나가는 분자생물학
-
Tracked from electriq reviews tv 2022/01/19 08:32
Delete
Neoways의 막나가는 분자생물학
-
Tracked from betsey johnson wallets macy's 2022/01/21 02:22
Delete
Neoways의 막나가는 분자생물학
-
Tracked from betsey johnson leopard wallet 2022/01/21 06:46
Delete
Neoways의 막나가는 분자생물학
-
Tracked from tobacco for pipes 2022/01/21 12:25
Delete
Neoways의 막나가는 분자생물학
-
Tracked from best leather wallet for women 2022/01/22 03:36
Delete
Neoways의 막나가는 분자생물학
-
Tracked from fapturbo forex robot 2022/01/22 08:12
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from jet benchtop milling machine 2022/01/23 07:21
Delete
Neoways의 막나가는 분자생물학
-
Tracked from relevant webpage 2022/01/25 09:48
Delete
Neoways의 막나가는 분자생물학
-
Tracked from sell my house fast 2022/02/01 13:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from enterprise management 2022/02/20 02:10
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from teen driving 2022/03/09 00:18
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Slot Online 2022/04/15 02:45
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Online Slots 2022/04/18 08:54
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from slot online 2022/04/29 04:09
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from Fortune88 Slot 2022/06/04 09:55
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from vermont outdoor concerts 2022/06/18 23:56
Delete
Neoways의 막나가는 분자생물학
-
Tracked from agen slot terbaik 2022/06/29 02:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://m.liancaiweb.com/home.php?mod=space&uid=2402818&do=profile&from=space 2022/07/19 03:11
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from lexsrv3.nlm.nih.gov 2022/08/06 05:23
Delete
Neoways의 막나가는 분자생물학
-
Tracked from авиатор 2022/08/07 02:14
Delete
Neoways의 막나가는 분자생물학
-
Tracked from aviator 2022/08/10 16:53
Delete
Neoways의 막나가는 분자생물학
-
Tracked from 안산출장마사지 2022/08/11 02:50
Delete
Neoways의 막나가는 분자생물학
-
Tracked from link w88 2022/08/13 06:19
Delete
Neoways의 막나가는 분자생물학
-
Tracked from w88plays 2022/08/24 05:05
Delete
Neoways의 막나가는 분자생물학
-
Tracked from โปรแกรม บา คา ร่า ออนไลน์ ฟรี 2022/08/26 07:13
Delete
Neoways의 막나가는 분자생물학
-
Tracked from DMT vape pen 2022/08/29 08:56
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from mpo4d 2022 2022/08/29 10:40
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 인천출장마사지 2022/09/03 02:45
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from 안양출장안마 2022/09/06 01:49
Delete
Neoways의 막나가는 분자생물학
-
Tracked from 제주출장마사지 2022/09/08 09:43
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from peterblum.com 2022/10/02 00:12
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from https://Nerdzillaclassifiedscolumbusohio.Nerdzilla.com/index.php?page=User&action=pub_profile&id=136587 2022/10/20 05:54
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from صحتك تهمنا 2022/10/27 03:37
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from نظام PSMF تجربتي 2022/10/30 09:08
Delete
Neoways의 막나가는 분자생물학 :: 암 억제 유전자인 p53의 새로운 제어기구를 발견
-
Tracked from weed for sale 2022/12/08 01:22
Delete
Neoways의 막나가는 분자생물학
-
Tracked from ดูหนังออนไลน์ 2022/12/12 12:46
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Bbs.Now.Qq.com 2022/12/24 10:41
Delete
Neoways의 막나가는 분자생물학
-
Tracked from สล็อตออนไลน์เว็บนอก 2023/01/17 01:44
Delete
Neoways의 막나가는 분자생물학
-
Tracked from site 2023/02/25 08:37
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Special Event Makeup Artist Nyc 2023/03/26 13:10
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Buy Glasses And Lenses Online 2023/08/21 17:25
Delete
Neoways의 막나가는 분자생물학
-
Tracked from online glasses for women 2023/08/22 09:35
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Online Shopping For Prescription Glasses 2023/08/26 17:14
Delete
Neoways의 막나가는 분자생물학
-
Tracked from Auto insurance cicero 2024/03/21 03:29
Delete
Neoways의 막나가는 분자생물학